Sujets d'examens (Parasitologie)
+7
pharminfo
sihem-22
cytomade
benzodiazepine
Admin
salvation
Flora
11 participants
Page 1 sur 4
Page 1 sur 4 • 1, 2, 3, 4 
 Sujets d'examens (Parasitologie)
Sujets d'examens (Parasitologie)
Bonjour tout le monde;
Et si vous aidez les jeunes , j'ai vu que plusieurs se posaient beaucoup de questions, peut être que les R1, R2, R3 et R4 :p pourraient éventuellement les éclairer
, j'ai vu que plusieurs se posaient beaucoup de questions, peut être que les R1, R2, R3 et R4 :p pourraient éventuellement les éclairer  .
.
Je commence:
Voili voilou
Et si vous aidez les jeunes
Je commence:
Scotch test, applications et exemples ???
Examen direct à l'etat frais en parasio et en myco :
- Interet
Application
Limites
Voili voilou

Flora- Résident II

- Messages : 235
Date d'inscription : 13/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
pour commencer 


















48H pour répondre à une simple question c trop !!!
et à savoir si ..... secouez vous un peu les parasitologues
48H pour répondre à une simple question c trop !!!
et à savoir si ..... secouez vous un peu les parasitologues

- Spoiler:
- la meilleure defense est l'attaque


salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
le Scotch test appelé (aussi test de Graham pour le St anal)
Technique simple qui consiste à appliquer un bout de cellophane adhésive sur l'anus pour test de Graham (ou sur la lesion suspecte pour d'autre agent)
> puis le mettre sur une lame porte objet
> lire au grossissement 10x
1 Parasites (helminthe)
Malasseziz sp.(agent du pityriasis versicolor), la levure donne un aspect en grappe de raisin
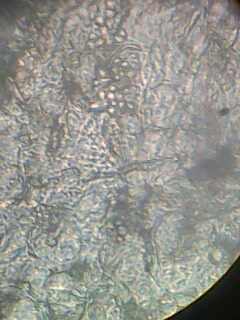
 [/url]
[/url]
Technique simple qui consiste à appliquer un bout de cellophane adhésive sur l'anus pour test de Graham (ou sur la lesion suspecte pour d'autre agent)
> puis le mettre sur une lame porte objet
> lire au grossissement 10x
a la recherche de ?
ce test est simple est indiqué dans le diagnostic de;1 Parasites (helminthe)
à la recherche des oeufs d'oxyures , oeufs de taenis saginata

2.Ectoparasites;
sarcoptes (agent de la gale),

qu'il faut differencié des dermatophagoides acarien non pathogène (sur le plan mycologique en dehors des allergies )
Demodex


A=acarien libre microscopique; B=sarcopte de la galeSarcoptes scabiei; C=Eriophyes; D=Demodexfolliculorum; E=tique Ixodes ricinus
3.Mycose ;
2.Ectoparasites;
sarcoptes (agent de la gale),

qu'il faut differencié des dermatophagoides acarien non pathogène (sur le plan mycologique en dehors des allergies )

Demodex

A=acarien libre microscopique; B=sarcopte de la galeSarcoptes scabiei; C=Eriophyes; D=Demodexfolliculorum; E=tique Ixodes ricinus
Malasseziz sp.(agent du pityriasis versicolor), la levure donne un aspect en grappe de raisin

 [/url]
[/url]

salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
pour l'examen direct en mycologie ,
il est indispensable au diagnostic , en cas de positivité , il oriente le clinicien .
dans des dermatophytes ex: teignes du cuir chevelu il apport le diagnostic immédiat qui permet la mise en route d'une thérapeutique sans attendre les résultats de la culture .
* il peut être un examen d'urgence ; le pronostic vital est mise en jeux par une cryptococcose cérébral dont l'examen mycologique a l'encre de chine du LCR peut mettre en évidence l'agent pathogène; levure encapsulé .
* dans le cas des champignons dimorphiques ou la culture est considéré comme très dangereuse l'ED reste l'outil Dc adéquat .
1.Examen direct à l'état frais sans préparation; flore vaginal ou grains de mycetome.
2.Examen direct après éclaircissement pour les chevaux , squames ou ongles
l'éclaircissant contient du potasse ou lactophenol ;additionné ou non d'un colorant .
3.Examen direct après coloration (frottis), des liquides,sérosités et appositions de tissus .
mais reste que la culture est toujours nécessaire pour l'identification des espèces .
il est indispensable au diagnostic , en cas de positivité , il oriente le clinicien .
dans des dermatophytes ex: teignes du cuir chevelu il apport le diagnostic immédiat qui permet la mise en route d'une thérapeutique sans attendre les résultats de la culture .
* il peut être un examen d'urgence ; le pronostic vital est mise en jeux par une cryptococcose cérébral dont l'examen mycologique a l'encre de chine du LCR peut mettre en évidence l'agent pathogène; levure encapsulé .
* dans le cas des champignons dimorphiques ou la culture est considéré comme très dangereuse l'ED reste l'outil Dc adéquat .
1.Examen direct à l'état frais sans préparation; flore vaginal ou grains de mycetome.
2.Examen direct après éclaircissement pour les chevaux , squames ou ongles
l'éclaircissant contient du potasse ou lactophenol ;additionné ou non d'un colorant .
3.Examen direct après coloration (frottis), des liquides,sérosités et appositions de tissus .
mais reste que la culture est toujours nécessaire pour l'identification des espèces .
Dernière édition par salvation le Sam 3 Avr - 1:41:02, édité 1 fois

salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
Bon travail Salvation



Admin- ADMINISTRATEUR

- Messages : 280
Date d'inscription : 05/02/2010
Localisation : Sur la terre
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
reste l'ED copro a vous ? 

salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
 , vaut mieux tard que jamais, mazal l'exam de toute façon
, vaut mieux tard que jamais, mazal l'exam de toute façon 
Flora- Résident II

- Messages : 235
Date d'inscription : 13/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
merci salvation 


benzodiazepine- Résident I
- Messages : 66
Date d'inscription : 28/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
allah iberek ...merci salfation

cytomade- Résident I
- Messages : 89
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
Svp si qq1 peu repondre aux questions:
1) 4 helminthe provoquant une anemie?
2) 2 helminthe ou l'autoinfestation est possible?
3) Parasite qui penetre chez homme a l'etat larvaire et adulte et parasitose produit par ces 2 etats.
4) 3 affections mycosiques consécutives a un traumatisme.
5) 4 champignons dimorphiques ?
6) 4 nematodes tansmission par des larves?
7) 3 especes : filamenteuse levuriforme et dimorphique.
1) 4 helminthe provoquant une anemie?
2) 2 helminthe ou l'autoinfestation est possible?
3) Parasite qui penetre chez homme a l'etat larvaire et adulte et parasitose produit par ces 2 etats.
4) 3 affections mycosiques consécutives a un traumatisme.
5) 4 champignons dimorphiques ?
6) 4 nematodes tansmission par des larves?
7) 3 especes : filamenteuse levuriforme et dimorphique.

sihem-22- Etudiant
- Messages : 4
Date d'inscription : 03/04/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
J'espère que ça prendra pas 48h cette fois ci  .
.

Flora- Résident II

- Messages : 235
Date d'inscription : 13/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
c en cours

salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
sihem-22 a écrit:Svp si qq1 peu repondre aux questions:
1) 4 helminthe provoquant une anemie?
2) 2 helminthe ou l'autoinfestation est possible?
3) Parasite qui penetre chez homme a l'etat larvaire et adulte et parasitose produit par ces 2 etats.
4) 3 affections mycosiques consécutives a un traumatisme.
5) 4 champignons dimorphiques ?
6) 4 nematodes tansmission par des larves?
7) 3 especes : filamenteuse levuriforme et dimorphique.

1. Trichuris trichura ,Ankylostomoses( Ancylostoma duodenale , Necator americanus ),
Bothriocéphale (anémie de type macrocytaire et mégaloblastique -pseudobiermérienne- due à la fixation par le parasite de la vitamine B12 )
2. Oxyurose(Eterobius vermiculeris) ;Anguillule ,Taenia solium
3.
a l'etat larvaire :Ecchinococcus granulosis (hydatidose);Echinococcus multilocularis (echinococcose alveolaire);
a l'etat adulte taeniasis :Taenia saginata /solium ,Hymenolepis nana;Diphyllobothrium latum.....
Taenia solium peut parasité l'homme aussi a l'etat larvaire (Cysticercose)
4. Sporotrichose (Sporothrix schenckii) ; Chromomycose ; mycetome fongique;lobomycose (Loboa loboi)....
5.Champignons dimorphiques :Histoplasma capsulatum/duboisii,Coccidioidomycose(Coccidioides immitis) ;Parcoccidioidomycose (Paracoccidioides braziliensis) ;Blastomycose (Blastomyces dermatitidis );Sporotrichose(Sporothrix schenckii )[
6.levuriforme: Candida sp(C. albicans), Malassezia sp (M. furfur),Cryptococcus sp.(C. neoformans)
filamenteux : dermatophytes (Microsporum canis , Trichophyton mentagrophytes,Epidermophyton floccosum )
moisissures ([i]Aspergillus sp. ...
Dernière édition par salvation le Dim 4 Avr - 0:35:29, édité 1 fois

salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)

 c sans vérification ce massage sera édité et mis à jour!!
c sans vérification ce massage sera édité et mis à jour!!
salvation- Résident II

- Messages : 258
Date d'inscription : 10/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
Je rajoute pour les dimorphiques: Sporothrix schenckii.

Flora- Résident II

- Messages : 235
Date d'inscription : 13/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
salvation a écrit:reste l'ED copro a vous ?
Déroulement des examens directs en techniques courantes
Examen macroscopique
Tout compte-rendu d'examen coprologique doit comporter une description des selles :
- leur couleur ;
- leur abondance;
-leur aspect : selles en billes (en scybales), en fragments, moulées, moulées fermes ou moulées molles, pâteuses, semi-liquides ou franchement liquides.
Les selles sont homogènes ou hétérogènes ; par exemple : selles dures fragmentées dans un liquide fécaloïde ou avec du sang, du mucus, etc..
Sera aussi notée la présence d'éléments nutritionnels macroscopiquement visibles et non mastiqués. Curieusement il arrive que ce soit le coprologiste qui signale au clinicien la mauvaise denture de son patient.
Naturellement les parasites macroscopiquement visibles seront recueillis à l'aide d'une pipette Pasteur ou de pinces souples et disposés dans une boîte de Pétri avec un peu de soluté physiologique de NaCI. Ils seront examinés secondairement à la loupe binoculaire et éventuellement subisolés et rincés.
On comprend l'avantage des boîtes transparentes pour repérer les parasites situés dans le fond des boîtes sous les matières fécales (ascaris, oxyures, anneaux de ténia par exemple).
Pour des selles non souillées d'urine la mesure du pH présente un intérêt dans l'étude de la physiologie de la digestion.
Examen microscopique standard
Examen direct en solution salée Isotonique
L'examen direct est le temps majeur de l'examen coproparasitologique. On dit parfois que dix examens directs bien effectués sont souvent plus intéressants et plus fiables que deux concentrations hâtivement lues.
A l'aide d'une fine baguette on prélèvera des selles en superficie et en profondeur À différents endroits en privilégiant les zones où des anomalies sont patentes (mucus sanglant).
Ces petites particules de matière fécale seront diluées sur lame dans une goutte de soluté NaCl à 9 °/oo, éventuellement tiédi.
La dilution doit être suffisante pour que, après écrasement sous une lamelle, il soit possible de reconnaître les caractères d'un journal à travers la préparation.
L'écrasement se fera avec le doigt protégé par un papier buvard et des doigtiers ou des gants protecteurs (absorption de l'excès de liquide et hygiène individuelle).
On lira toute la ou les préparations aux objectifs faibles et on regardera au moins une centaine de champs microscopiques à l'objectif x 40. L'objectif à immersion sera réservé pour des études fines d'un parasite déjà repéré.
En solution de Lugol double
Les même dilutions seront effectuées dans une goutte de solution de Lugol double et examinées avec le même soin en sachant que, dans cette solution, les protozoaires s'immobilisent rapidement mais que la chromatine des noyaux colorée en sombre est bien nette.
Avec la solution de Lugol, la flore iodophile du colon apparaît en brun et l'amidon mal digéré en bleu ; l'amidon transformé en érythrodextrine est coloré en rouge violet.
La dilution en eau distillée
Elle peut être d'un certain secours lorsqu'une grande abondance de blastocystts ou de formes végétatives d'autres protozoaires rend difficile le repérage des kystes éventuels.
Ces derniers résistent bien à l'eau alors que les formes végétatives éclatent rapidement ; parfois avant de mourir elles se gonflent et leur noyau apparaît (Dientamœba fragilis).
Examen microscopique direct après colorations spéciales
Les colorations spéciales sont effectuées pour préciser la morphologie d'un protozoaire observé et par conséquent pour affiner le diagnostic
d'espèce. Elles peuvent correspondre à une recherche spécifique d'un parasite, Cryptosporidium, responsable de diarrhées du nourrisson ou des sujets immunodéficients.
Enfin la technique de Kalo est plus une décoloration qu'une coloration ; elle permet de mieux repérer certains œufs de parasite et éventuellement de pratiquer une numération de ces œufs.
Colorations en tubes
- Au Merthiolate Iode Formol (technique de Sapero, Lawless et Strome) Dans un tube à hémolyse on met 0,15 ml d'une solution de Lugol à 5%. On y ajoute 2,35 ml d'une solution de merthiolate-éosine-formol en respectant bien l'ordre ci-dessus (ne pas ajouter la solution iodée à la solution de merthiolate ; ne préparer le mélange qu'au moment de l'emploi pour éviter les précipités).
Après mélange, la coloration des selles peut s'effectuer en ajoutant dans le tube un gros pois de matières fécales à l'aide d'une tigelle qui permet d'homogénéiser le tout.
Après vingt à trente minutes, les selles se sont déposées dans le fond du tube. La couche superficielle du sédiment est ta plus riche en protozoaires. Les formes végétatives sont fixées immédiatement, pseudopodes encore visibles. La chromatine des noyaux est colorée en brun par l'iode.
Les kystes mûrs apparaissent en clair sur fond rose et semblent donc avoir des reflets verdâtres, Leurs noyaux fixés par le formol sont nets et parfois déjà colorés par l'iode. Ultérieurement l'éosine pénètre à l'intérieur des kystes.
Des selles ainsi fixées peuvent être conservées plusieurs mois voire plusieurs années en boîte obscure* Pour les réétudier, il est nécessaire
de bien agiter le tube puis de le laisser de nouveau reposer pendant vingt minutes.
- Coloration au cristal violet de Bailenger
La coloration de Bailenger peut être réalisée en tube ou directement sur la lame en diluant une goutte de la suspension de selles avec le colorant.
Les parasites sont colorés très rapidement. Le cytoplasme des protozoaires devient rose tandis que la chromatine des noyaux apparaît
en noir. Cette coloration est stable pendant plusieurs jours.
Coloration sur lame
-Coloration à l'hématoxytine ferrique
Les protozoaires ont été décrits après coloration par cette technique de référence. Il est donc nécessaire de la connaître malgré la difficulté de son exécution.
-Effectuer un étalement humide:
. sur une lame bien dégraissée, déposer une goutte de selles (ou de mucus) pures si elles sont liquides ou diluées dans du soluté
isotonique éventuellement additionné d'un dixième de sérum (meilleure fixation);
. avec te bord d'une lamelle réaliser l'étalement en faisant des zigzags et des changements de vitesse d'exécution pour obtenir des différences d'épaisseur
-Fixer immédiatement sans laisser sécher:
. soit par la solution ordinaire de Bouin, fraîchement préparée (durée de fixation : au moins 15 n) puis passer la lame dans deux
bains d'alcool à 90° puis un bain d'alcool à 70° où la lame peut rester quelques jours. Il est possible de retirer l'excès (lames jaunes) d'acide picrique restant par du carbonate de lithium à 1% puis de rincer à l'eau
. soit par le fixateur de Duboscq-Brasil recommandé pour les kystes; durée de la fixation : 15 minutes;
.soit par la solution de Schaudinn acétique qui semblerait la meilleure ; durée de la fixation : I heure.
Avant la coloration, plonger la lame 10 à 20 minutes dans un bain d'alcool à 70°, additionné d'iode (couleur ambrée) puis rincer dans des bains d'alcool A 70° avant de laver à l'eau.
- Mordancer : plonger la lame dans une solution aqueuse d'alun de fer à 3% : 30 minutes à l'étuve A 37°.
-Colorer à l'hématoxyline : plonger la lame dans les bains d'hématoxyline à température de la pièce 24 h sont nécessaires pour bien colorer les amibes. Dans l'étuve à 37°, 30 à 60 minutes peuvent suffire. Les parasites sont alors bien noirs.
-Différencier avec la solution aqueuse d'alun de fer A ï% en surveillant au microscope cette différenciation jusqu'à ce que les
noyaux apparaissent nettement.
-Arrêter la différenciation par d'abondants lavages à l'eau.
- Déshydrater par passage dans deux bacs d'alcool A 70°, deux bacs d'alcool à 90°, un bac d'alcool à 95°, deux bacs d'alcool absolu; par deux ou trois bacs de toluène (ou xylène) on rend la lame susceptible de recevoir une goutte de baume de Canada ou de baume synthétique et la lamelle est posée définitivement.
-Coloration à l'A.P,V.-Trichrome
L'irrégularité des résultats de cette technique, liée à la difficulté d'obtenir dés produits chimiques de qualité, nous fait regretter de ne pouvoir la conseiller dans le cadre des examens systématiques. Les images obtenues sont en effet, quand la coloration est réussie, extraordinaires de pureté.
- Frottis :
.diluer au quart sur une lame une petite goutte de selles dans la solution d'APV et mélanger avec un petit agitateur;
. étaler en couche mince sur environ le tiers de la lame; les colorations seront ultérieurement effectuées en tube Borrel ;
Remarque : la dilution peut être effectuée en tube à hémolyse et le frottis différé de plusieurs mois si nécessaire.
-Coloration :
. mettre les frottis dans de l'alcool à 70° contenant assez d'iode pour donner une coloration ambrée à la solution : 3 h 10 min ;
. alcool à 70° : 2 min;
. alcool à 50* :2 min;
. rincer à l'eau du robinet , solution de Gomori : 30 min ;
. alcool à 90° contenant 0,5 % d'acide acétique ; 5 A 10 secondes ;
. alcool à 95° : rincer pendant 30 secondes environ.
- Montage
. alcool absolu : une minute ;
. xylène : 5 minutes;
. montage en baume synthétique.
- Coloration au noir chlorazol de Kohn
Cette coloration permet de colorer les trophozoïtes en gris et de bien voir la structure des noyaux. Les kystes apparaissent en bleu pâle avec des noyaux bien nets. C'est une technique facile à réaliser.
- Effectuer un étalement humide mince si possible (cf. technique ci-dessus).
- Plonger la lame dans le fixateur colorant de Kohn et la laisser 8 A 10 heures.
- Laver à l'eau courante, déshydrater et monter au baume de Canada ou au baume synthétique comme ci-dessus.
- Colorations pour recherche de cryptosporidies
La technique actuellement reconnue comme la plus fiable pour trouver des ooeystes de Cryptosporidium est la coloration de Ziehl-Neelsen modifiée par Henriksen et Pohlenz.
Elle s'effectue sur frottis mince de selles ou sur le surnageant après centrifugation des selles selon la technique de Janeckso-Urbanyi
-Sécher le frottis à l'air
- Fixer au méthanol pur pendant 5 minutes
- Sécher de nouveau.
- Colorer la lame dans un bain de fuchsine phéniquée :1 heure.
- Rincer à l'eau puis différencier dans de l'acide sulfurique A 2 % pendant 20 secondes en agitant la lame.
- Rincer à l'eau puis colorer dans une solution de vert malachite à 5 % pendant 5 minutes ou dans une solution de bleu de méthylène à 3%.
- Rincer à l'eau et sécher à l'air.
Les cryplosporidies apparaissent en rouge sur fond verl ou bleu et sont donc faciles à repérer à l'objectif x 40 et à diagnostiquer à l'immersion (objectif x 100). D'autres techniques proposées ont une valeur certaine (colorations à l'aura mi ne, par anlicorps monoclonal fluorescent,...) mais elles nécessitent l'emploi d'un microscope à fluorescence, sont souvent chères et ne sont pas d'un emploi facile pour tout laboratoire et à toute heure.
La coloration par les solutions de May-Crunwald et de Ciemsa ne nous semble pas de lecture aisée.
- Coloration pour recherche de microsporidies
Les spores ÛEnterocytozoon bicntusi, visibles après une coloration générale aux solutions de May-Crunwald et Giemsa, sont plus
facilement mises en évidence par la technique de coloration au trichrome :
- Formoler la selle dans une solution de formol à 10%.
- Effectuer un frottis de la selle.
- Fixer le frottis pendant 5 minutes dans un bain de méthanol.
-Plonger dans la solution de chromotrope 2R, 90 minutes, -Rincer deux fois:
. à l'eau du robinet d'abord ;
. en solution acide-alcool ensuite:
. acide acétique : 4,5 ml
. alcool à 90%: 995,5 ml Les spores, recherchées à l'objectif x 100, apparaissent en rouge.
Technique de décoloration des selles
La technique de Kato permet de distinguer rapidement à un faible grossissement les œufs de parasites dans une préparation épaisse de selles rendue translucide par la solution de glycérine-vert malachite.
- Des bandes de cellophane de 3 x 2 cm sont immergées pendant au moins 24 heures dans une solution de glycérine-vert malachite.
- Déposer et étaler grossièrement environ 20 à 50 mg de matières fécales (exactement 20 mg pour une numération) sur une lame porte-bjet.
- Recouvrir par une des bandes de cellophane préalablement apprêtées.
-Presser à l'aide d'un papier filtre pour répartir régulièrement la couche de selles.
-Laisser la préparation s'éclaircir pendant 10 minutes à une distance de 20 cm d'une lampe de 100 w (ou 1 h à la température ambiante ou 30 minutes A 30° C ou 12 minutes à 42° C).
- Examiner sans plus attendre pour éviter une altération voire une lyse des œufs.
Dernière édition par Admin le Dim 4 Avr - 1:23:35, édité 1 fois

Admin- ADMINISTRATEUR

- Messages : 280
Date d'inscription : 05/02/2010
Localisation : Sur la terre
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
Les concentrations
On appelle concentrations les techniques par lesquelles on essaie. A partir de la grande quantité de matières fécales recueillies, d'obtenir dans un faible volume les œufs, larves, kystes voire formes végétatives fixées de parasites par élimination des résidus de la digestion.
Pour ce faire, on joue sur les densités et affinités différentes de ces résidus et des parasites recherchés.
La grande diversité des constituants des selles et des espèces parasites explique que les concentrations ne puissent être totalement efficaces sauf peut-être les concentrations dites combinées qui sont en réalité la succession de plusieurs techniques sur le même échantillon de selles.
Seront donc envisagées successivement les méthodes physiques, les méthodes physico-chimiques et les méthodes combinées.
Dans le grand nombre de méthodes proposées seront présentées celles qui, pour leur commodité et leur efficacité, sont les plus utilisées dans les laboratoires français dont les résultats semblent très fiables sur le plan international.
Techniques générales
Le choix des techniques
- Enquête épidémiologique spécifique
Pour une enquête recherchant une espèce particulière de parasite, on devra choisir une technique plus spécifique pour trouver ce parasite. Il faudra tenir compte de sa facilité d'exécution et de son prix de revient.
- Enquête épidémiologique générale sur le terrain
Pour une étude plus générale, les techniques devront être faisables après transport donc fixation des matières fécales. Le fixateur peut modifier le résultat de certaines techniques par ailleurs très efficaces.
-Analyse coproparasitologique pour un malade
Il est recommandé pour un cas clinique particulier d'effectuer soi! une technique combinée soit deux techniques différentes sans hésiter à pratiquer une voire deux autres techniques sî l'interrogatoire ou les renseignements cliniques permettent une orientation vers une parasitose donnée.
Prélèvements pour concentration
Aussi bien certains œufs que les kystes sont répartis irrégulièrement dans les matières éliminées en une seule défécation. Il est donc nécessaire de prélever des fragments de selles à différents endroits à l'aide d'un agitateur de verre aplati en palette.
Homogénéisation, flltration
- Homogénéisation
Quel que soit le liquide diluant, les selles devront être triturées dans un verre à pied, au début dans une très petite quantité de liquide pour obtenir une pâte qui sera secondairement étendue. Le résultat sera un diluât correspondant A ce qui est recommandé pour la technique choisie.
- Filtration
Pour éliminer les particules alimentaires non fragmentées (peaux de fruits par exemple), le diluât obtenu est filtré à travers une passoire (forme chinois) à mailles de 1 mm2 environ et de 7 cm d'ouverture et recueilli dans un autre verre à pied.
Un peu de liquide propre permet de rincer la passoire et d'emporter les éventuels œufs restés dans les mailles.
La passoire, après usage, sera brossée et flambée (destruction d'œufs éventuellement restés accrochés dans les mailles).
- Brève sédimentation
Après moins d'une minute le filtrat sera transvasé lentement dans un autre verre ou directement utilisé. Ces quelques secondes de sédimentation permettent aux petits éléments lourds de tomber dans le fond du verre à pied (cellules sctéreuses de poires par exemple).
Concentrations par les méthodes physiques de sédimentation
Sédimentation simple
- Intérêt
Technique recommandée pour les larves d'anguillule et les œufs d'ascaris non fécondés. Elle ne nécessite pas de produit chimique particulier.
- Inconvénients
De nombreuses cellules végétales (féculents en particulier) sédimentent aussi vite que les parasites recherchés et l'examen microscopique n'est pas toujours facile.
- Déroulement de la technique
Dix à vingt grammes de selles sont dilués dans 250 à 500 ml d'eau du robinet et le filtrat laissé dans un verre à pied. Après une heure, le surnageant est rejeté et le sédiment remis en suspension dans une même quantité d'eau. La même manipulation est renouvelée plusieurs fois jusqu'à obtention d'un liquide surnageant clair. Le culot est alors examiné.
Certains, au lieu d'attendre la sédimentation, gagnent du temps par des centrlfugations lentes.
Méthode de Faust et Ingalls en eau glycérinée
- Intérêt
Celte technique de terrain est employée pour rechercher les œufs de Schistosoma mansoni mais permet aussi de trouver œufs d'Ascaris non fécondés et larves d'anguillule.
- Inconvénients
Comme pour la technique précédente, l'examen microscopique peut être rendu difficile par la présence de certains résidus.
- Déroulement de la technique
Cinq grammes de selles sont dilués dans 300 ml d'eau glycérolée à 0,5%. On pratique trois sédimentations successives en verres à pied d'une durée de 1 heure, 45 minutes puis 30 minutes.
Les œufs de schistosomes sont plutôt en superficie du sédiment mais il est recommandé d'effectuer des prélèvements A différents niveaux.
Méthode de Van Someren et Grégoire en colonne haute
- Intérêt
Cette technique vétérinaire est utilisée par certains médecins pour rechercher essentiellement les œufs de grande douve.
- Inconvénients
L'inconvénient majeur de cette technique réside dans la nécessité d'utiliser un appareillage spécial c'est-à-dire un tube de verre de 1 cm de diamètre intérieur et de 2,10 m de haut. En bas de ce tube un tuyau de caoutchouc de quelques centimètres peut être fermé par une pince. Il relie le grand tube de verre à un autre tube de verre, court, muni d'un robinet.
- Déroulement de la technique
Le grand tube est empli de solution de Teepol à 1 % en évitant une forte agitation (bulles). Quatre grammes de selles diluées dans 3(j ml de celle même solution sont tamisées à travers la passoire ordinaire voire A travers une deuxième passoire à mailles plus fines (un tiers de millimètre de côté).
Le filtrat est versé lentement dans le liquide de la colonne. Après 20 minutes exactement la pince du tuyau en caoutchouc est serrée et. au robinet, on recueille quelques gouttes de liquide où se sont condensés les œufs de douve particulièrement denses (densité : 1,2).
concentration par les méthodes physiques de flottation
Les méthodes de flottation reposent sur le principe que les œufs ont une coque qui les protège pendant un certain temps de la pénétration de liquides plus denses; une dilution avec ces liquides aura tendance A les laisser flotter en surface tandis que les résidus plus lourds ou ceux qui s'imprègnent rapidement tombent dans le fond des récipients.
Comme pour les méthodes de sédimentation, la simplicité des formules pour préparer le liquide de dilution ne nécessite pas un alinéa spécifique pour le formulaire.
Méthode de Willis
- Intérêt
Dans les enquêtes épidémiologiques, cette technique présente l'avantage de la simplicité d'exécution, de la rapidité et d'un faible prix de revient (eau chlorurée sodique). Elle concentre bien les œufs d'ancylostomidés et dhyménolépidés.
- Inconvénients
La solution de chlorure de sodium pénètre assez facilement dans les œufs et il ne faut pas dépasser le temps prescrit dans le déroulement de la technique.
- Déroulement de la technique
Les selles sont diluées au dixième environ dans une solution aqueuse de chlorure de sodium à saturation (25 grammes dans 100 ml environ; densité 1 200), puis filtrées rapidement.
La suspension obtenue est versée dans un tube jusqu'à la limite supérieure (léger bombement du liquide au dessus du bord)* On place alors
délicatement une lamelle qui doit recouvrir tout le tube sans bulle d'air.
Un quart d'heure plus tard on retire la lamelle qui est déposée sur une lame et la lecture de la concentration est effectuée avant évaporation de Veau et cristallisation du sel ce qui. en pays chaud, peut se produire rapidement.
Méthode de Faust simplifiée
- Intérêt
Alors que la méthode originale exige plusieurs sédimentations dans Peau par centrifugalion, avant la flottation, dans la méthode simplifiée
on se contente d'une seule centrifugation.
- Inconvénients
La densité du liquide de dilution (1,18) est proche de celle de la solution de Willis et n'a pas l'avantage de la simplicité pour se procurer le corps chimique de base (sulfate de zinc). Cette méthode ne permet guère de trouver plus d'œufs que la méthode de Willis. Elle exige
l'utilisation dune centrifugeuse.
- Déroulement de la technique
Les selles sont diluées au dixième environ dans une solution saturée de sulfate de zinc (sulfate de zinc 331 g, eau qsp 1000 ml), tamisées et centrifugées environ une minute à 2300 tours/minute. Dès l'arrêt de la centrifugation, on prélève à l'anse métallique la couche superficielle qui contient les œufs et on la dépose sur une lame pour examen.
Méthode de Janeckso et Urbanyl
- Intérêt
La technique proposée par Janeckso et Urbanyi concentre bien les œufs de grande douve, de schistosomes et d'ancylostomidés ainsi que les larves d'anguillule dont les déformations éventuelles n'Interdisent pas la reconnaissance* Elle concentre assez bien tes embryophores de ténia et les unifs de trichocéphale.
- Inconvénients
La solution iodo-mercurique est toxique (étiquette rouge), doit être conservée dans un flacon bien bouché et est très corrosive. Elle forme avec les métaux des balances, des divers matériels (centrifugeuse, tuyaux de plomb) et surtout des bijoux (alliances, montres-bracelets), des amalgames irréversibles. Comme presque toutes les méthodes de flottation, cette technique est Inefficace pour trouver les kystes sauf ceux de Giardia.
-Déroulement de la technique
Trois à cinq grammes de selles sont triturés dans 20 ml de la solution iodo-mercurique (biiodure de mercure 150 g, iodure de potassium 110 g et eau 400 ml).
Pour préparer la solution : dissoudre l'iodure dans un peu d'eau, ajouter le biiodure en remuant, puis après dissolution complète, ajouter le reste de l'eau. La densité obtenue est de l 440.
Après tamisage, le filtrat est centrifugé à 2 500 tours/mn pendant 3 à 4 minutes. La couche superficielle recueillie à l'aide dune anse ou d'une baguette de verre aplatie en spatule est examinée au microscope dans le quart d'heure qui suit.
Méthodes physico-chimiques (méthodes diphasiques)
Principes théoriques
- Principes
Par une solution chimique, certains résidus fécaux sont dissous et d'autres acquièrent une affinité pour l'éther. Le principe de ces techniques est donc de mélanger les selles avec une solution déterminée puis d'agiter le tout avec de l'éther avant de centrifuger pour recueillir œufs
et kystes.
Bailenger a montré que le pH de la solution était l'élément déterminant pour la plus ou moins grande efficacité d'une technique selon le parasite recherché. Par exemple, pour les œufs d'ankylostomes, un pH acide est plus favorable mais en revanche, pour les omfs de S. mansoni, il recommande un pH basique.
- Détails techniques de la centrifugation
. Préparation
Les selles triturées (mélange au dixième environ) dans la solution choisie sont tamisées à travers une passoire comme cela est décrit pour les techniques physiques puis, après moins dune minute de brève sédimentation, le filtrat est versé dans un tube à centrifuger à fond conique
en le remplissant à moitié ou aux deux tiers.
On ajoute de l'éther en laissant un espace vide au dessus de la couche éthérée pour permettre une bonne agitation.
Le tube bouché à la main protégée d'un gant (matériau non soluble dans l'éther) est alors agité énergiquement pendant au moins trente secondes à une minute et, sauf pour le M.I.F.-concentration, aussitôt centrifugé. Il faudra prendre garde aux possibles petites projections d'éther souillé en retirant la main de l'orifice du tube.
.Centrifugation
La suspension éthéro-Hquide obtenue est centrifugée A une vitesse lente de l'ordre de 1500 à 2000 tours/minute pendant une à trois minutes.
- Résultats de la centrifugation
Après centrifugation, les constituants de la suspension sont répartis en quatre couches :
. couche superficielle d'éther coloré par les corps éthéro-solubles (graisses diverses) ;
. couche épaisse et adhérant aux parois du tube, contenant les résidus lipophiles ;
. couche de solution aqueuse de dilution colorée par les corps hydrosolubles ;
. culot devant contenir les parasites et qui doit être aussi petit que possible voire presque indiscernable à l'oeil nu.
- Suite de la technique
. Décoller la couche des résidus lipophiles à l'aide d'une baguette de verre.
. Retourner le tube au dessus de l'évier (en faisant couler de l'eau) ou d'un bac à déchets liquides.
Penser qu'ainsi est jeté de l'éther, donc travailler loin d'une flamme ou... d'une cigarette; penser également que, dans la technique au MlF-concentratlon (comme précédemment dans la flottation de Janeckso-Urbanyi), sont rejetês des sels de mercure considérés comme toxiques et faisant l'objet d'une réglementation pour le contrôle sanitaire des eaux usées. En France, les liquides contenant des sels de mercure doivent être recueillis dans des récipients de plastique bouchés, qui seront confiés à des services spécialisés. . Essuyer les parois du tube avec un coton tenu à la pince en laissant toujours le tube avec l'ouverture dirigée vers le bas pour éviter de souiller le culot avec les résidus.
. Retourner alors le tube et ajouter une goutte de solution isotonique pour remettre en suspension le culot qui sera examiné;
- Prélèvement du culot
Le culot sera prélevé à la pipette Pasteur mais il est impératif de ne pas aspirer. Le liquide devra monter par capillarité dans l'effilure, au besoin en penchant légèrement te tube. En aspirant on risquerait, en effet, que le culot ne montât au delà de l'effilure et que les parasites
recherchés et le liquide se répartissent sur toute la surface interne de la pipette Pasteur : tout serait alors à refaire.
Méthode de Telemann modifiée par Rivas
- Avantages
Facile à pratiquer, rapide, cette technique concentre bien les parasites les plus courants (Gfordia, Entomet œufs de trichocéphale).
La coque des kystes d'Entamœba histolytica se dédouble lors de la centrifugation ce qui est un argument diagnostique intéressant.
- Inconvénients
Les œufs de bilharzies, d'ascaris ou de grande douve restent dans la couche lipophile: c'est donc une méthode à déconseiller dans les pays où sévissent ces parasites.
- Déroulement de la technique
Aucune particularité n'est à signaler par rapport À la technique générale des concentrations diphasiques.
Méthode de Caries et Barthélémy
- Avantages
Par cette technique le culot obtenu est très faible et, débarrassés de la majorité des bactéries des selles, tes parasites apparaissent "propres". Les œufs de trichocéphale ou d'ankylostome et les kystes amibiens sont retrouvés aisément et facilement identifiables.
- Inconvénients
Le pH particulièrement bas (1,8 est défavorable pour retrouver les œufs de schistosomes ou les larves d'anguillule. Par ailleurs la technique exigeant deux centrifugâtions est plus longue que les techniques en un temps.
- Déroulement de la technique
Une première centrifugation du filtrat obtenu après dilution dans le liquide A (eau isotonique formolée) permet d'éliminer, avec le surnageant, des bactéries et des substances hydrosolubles.
Une seconde centrifugation est effectuée après mise en suspension du culot dans le liquide citrique B et agitation avec une quantité égale d'éther. Seul le culot est examiné.
Méthode de Bailenger
La méthode proposée par Bailenger tient compte de l'importance du pH mais la technique ne diffère pas de celle de Telemann et Rivas.
- Avantages
Elle est beaucoup plus fiable dans la recherche des kystes et des œufs se concentrant bien dans un pH aux environs de 5 (giardia. amibes, trichocéphale, ankylostome).
- Inconvénients
Pour rechercher les œufs de schistosome une autre technique est nécessaire.
- Déroulement de la technique
Les manipulations sont identiques à celles de la méthode de Telemann et Rivas.
Méthode de Thébault simplifiée (Valentin et Solle)
La méthode de Thébault est en réalité une méthode combinée mais rares sont les techniciens qui n'utilisent pas la méthode simplifiée proposée par Valentin et Solle.
- Avantages
L'émulsion avec l'éther est pratiquée dans une ampoule à décanter et par conséquent il est possible de techniquer sur une plus grande quantité de selles.
Cette méthode est particulièrement intéressante pour concentrer les kystes des petites amibes et en particulier les Eudolimax i\\atw$ dont les noyaux deviennent, grâce au formol du liquide de dilution, extraordinairement nets. On retrouve également, fixées, des formes égétatives d'amibes et les œufs de trichocéphale.
- Inconvénients
Les kystes d'Entamoeba coli et surtout de Giadia descendent assez mal. C'est donc une excellente méthode à utiliser seulement pour réciser
le diagnostic de rares kystes observés à l'examen direct ou après une méthode altérant leur morphologie.
- Déroulement de la technique
On dilue 10 g de selles environ dans 100 ml de solution d'acide trichloracétique. Le filtrat obtenu après tamisage doit reposer une minute avant d'être versé dans une ampoule à décanter (forme ballon ou forme poire). On ajoute une quantité égale d'éther et on agite rigoureusement en faisant évacuer l'éther vaporisé par ouverture du robinet tenu en haut (risques de projection du bouchon si ce geste n'est pas effectué).
On laisse reposer 2 à 10 minutes avant de retirer le bouchon et de soutirer quelques centimètres cubes que l'on centrifugera. Le culot sera examiné au microscope. Dans la technique originelle le culot est repris par la solution bromurée. Une deuxième centrifugation permet, par flottation, de recueillir les parasites en surface. La technique originelle de Thébault est donc une méthode combinée.
Méthode de Ritchie simplifiée
- Avantages
Cette méthode peut être utilisée sur les selles formulées donc sur des selles collectées pour enquêtes épidémiologiques. Elle concentre bien les œufs d'ascaris et de schistosome.
- Inconvénients
Le culot souvent volumineux est de lecture difficile.
- Déroulement de la technique
Mis à part le liquide de dilution, la technique est la même que pour la concentration de Teleman-Rivas.
Méthode de Blagg et al.
- Avantages
Celte méthode permet de concentrer les œufs de schistosome et d'ascaris. Les kystes de protozoaires voire les formes végétatives sont colorés et ainsi facilement identifiables.
- Inconvénients
Le culot obtenu est souvent important. La manipulation de grandes quantités de liquide coloré à l'éosine augmente les risques de taches et surtout la présence de mercure souille les effluents du laboratoire.
- Déroulement de la technique
Les selles sont diluées au dixième dans la solution de merthiolate-formol, pure ou additionnée de Lugol à 5 % (cf. coloration des selles). Après tamisage le filtrat est versé dans un tube à centrifuger où l'on ajoute moitié moins d'éther. Une agitation énergique permet d'obtenir une suspension qu'on laisse reposer deux minutes.
Si la suspension reste stable la centrifugation (1700 tours/minute pendant 1 minute) permet d'obtenir un culot qui sera prélevé avec les soins habituels et examiné.
Si l'éther forme une couche superficielle libre il faut ajouter un millilitre d'eau et recommencer l'agitation.
On remet de l'eau jusqu'à l'obtention d'une suspension stable après deux minutes et c'est alors seulement que la centrifugation peut être effectuée.
Méthodes combinées
Chaque méthode de concentration proposée présente l'inconvénient d'éliminer des parasites et doit donc être choisie en (onction de ce que Ton recherche préférentiellement.
Les méthodes les plus intéressantes pour la diversité des kystes ou œufs concentrés laissent souvent à examiner un culot relativement important,
En combinant ftottations et méthodes diphasiques, C. Junod obtient d'excellents résultats.
Première méthode de Junod
- Avantages
Les statistiques publiées par Fauteur de cette méthode montrent sa productivité. C'est certainement Tune des méthodes les plus intéressantes tant pour les recherches d'ceufs que pour celles de formes végétatives ou kystes de protozoaires. Elle remplace l'exigence
de plusieurs techniques différentes pour trouver des parasites de densité différente.
- Inconvénients
Cette technique nécessitant cinq centrifugations demande un temps assez long. D'autre part l'utilisation d'une solution d'iodo-mercurate présente les inconvénients déjà signalés pour la méthode de (aneckso et Urbanyi (solution toxique et corrosive).
- Déroulement de la technique
. Concentration diphasique (M1F Concentration ou Bailenger) en utilisant peu d'élher et en agitant modérément pour obtenir volontairement un culot important (première centrifugation).
. Le culot est remis en suspension dans une solution de sulfate de zinc à saturation. On pratique alors une deuxième centrifugation pendant 30 secondes S faible vitesse ce qui permet d'obtenir un surnageant et un culot (deuxième centrifugation)
. Ce surnageant est dilué au quart avec de l'eau distillée et centrifugé (troisième centrifugation); le culot est examiné.
. Le culot de la deuxième centrifugation est repris dans une solution d'iodomercurate de potassium de densité 1,5 (cf. formulaire) et la suspension est de nouveau centrifugée (quatrième centrifugation). Le surnageant est repris et dilué. Ce dernier diluât est centrifugé (cinquième centrifugation) et le culot est examiné.
Deuxième méthode de Junod (Junod simplifiée)
- Avantages
C. Junod considère que sa technique simplifiée donne autant de bons résultats que la technique complète.
- Inconvénients
Quoique simplifiée, la technique impose encore quatre centrifugations et l'emploi d'une solution de iodomercurate.
- Déroulement de la technique
. Mettre en suspension environ 8 g de selles dans 50 ml de solution de NaCI à 8,5 %o, éventuellement formolée à 8 %. Tamiser, centrifuger à
1200 tours/minute pendant une minute, éliminer le surnageant, faire une préparation d'une microgoutte du culot, l'examiner et remettre en suspension le reste du culot dans 20 ml d'une solution isotonique formolée.
Remarque : quand cette méthode combinée intervient en complément d'une technique polyvalente usuelle, cette première centrifugation peut être supprimée.
. Ajouter 5 à 7 ml d'éther éthylique, agiter modérément, centrifuger à 1200 tours/minute pendant une minute et conserver le culot.
. Remettre le culot en suspension dans 4 à 6 ml de solution d'iodomercurate (solution B ci-dessous de densité 1,40), centrifuger à 1200 tours/minute pendant deux minutes: évacuer le surnageant et examiner le culot en totalité au microscope.
Méthode de sédimentation-flottation pour œufs et larves
- Avantages
Pour une recherche spécifique d'œufs ou de larves, Junod considère que la méthode ci-dessous est plus productive.
- Inconvénients
Quand la teneur des selles en lipides est anormalement élevée, les concentrations sans éther sont encombrées de graisses neutres, savons et acides gras.
- Déroulement de la technique
. Première centrifugation (1200 tours/minute, une minute) de la suspension fécale en eau 5 8,5 % de NaCl; culot conservé.
. Mise en suspension du culot dans 20 ml de solution acéto-acétique formulée sans adjonction d'éther et centrifugation à 1200 tours/minute
pendant une minute; aspirer le surnageant et la partie superficielle du culot.
. Mise en suspension du culot dans 5 à 7 ml de solution d'iodomercurate de potassium de densité 1,35 et centrifugation (1200 tours/minute pendant une minute).
. Transfert (décantation) du surnageant dans un autre tube conique, adjonction de 20 ml d'eau et centrifugation (1200 tours/minute pendant deux minutes).
. Examen du culot
Sédimentation-flottation au saccharose pour protozoaires
- Avantages
Également mise au point par C Junod, cette technique, bien exécutée, permet de trouver de rares formes végétatives de protozoaires alors que les kystes sont inexistants. Elle est d'exécution rapide et surtout recommandée quand l'examen direct a prouvé la présence de rares formes végétatives et qu'aucun kyste n'a été retrouvé pour pouvoir affirmer le diagnostic. Elle est utilisable sur des selles fixées au MLR
- Inconvénients
Une certaine technicité est indispensable pour ne pas confondre les amibes et flagellés avec les blastocystis et champignons qui sont un peu déformés. De plus une selle trop riche en lipides ne peut être ainsi concentrée. Noter en outre que des sels de mercure sont encore utilisés.
- Déroulement de la technique
. Fixation :
■ triturer 3 à 4 grammes de selles dans 50 ml de solution acéto-acétique formolée fraîchement préparée (solution MIF) ;
■ tamiser et recueillir en tube bouché ;
■ attendre au moins 2 à 3 heures avant de poursuivre.
. Sédimentation
■ centrifuger 10 à 15 ml de la suspension à 1800-2000 tours/minute pendant 90 secondes dans un premier tube (T1) ;
■ rejeter le surnageant ;
■ prélever (lame 1) el garder en milieu humide (boîte avec colon hydraté) la couche supérieure du culot.
. Flottalion
■ verser, dans le tube Ti, 8 & 10 ml de solution de saccharose (cf. formulaire) puis 0,5 ml de solution de chlorure mercurique à 1,5 % en eau distillée;
■ agiter très doucement (éventuellement avec un agitateur) ;
■centrifugera 1000 tours/minute pendant 45 secondes;
■décanter le surnageant dans un tube T2 (si une partie est peu limpide ne garder que 1 ou 2 ml de la partie supérieure) ;
■ prélever et garder ta surface du culot (lame 2).
. Précipitation
■ ajouter 20 à 30 ml d'eau dans le tube T2 et diluer le culot ; • centrifuger à 2000 tours/minute pendant 90 secondes ;
■ examiner le culot (lame 3).
. Lecture dans l'ordre des lames 3 puis 1 et 2 si la lame 3 n'est pas satisfaisante.
On appelle concentrations les techniques par lesquelles on essaie. A partir de la grande quantité de matières fécales recueillies, d'obtenir dans un faible volume les œufs, larves, kystes voire formes végétatives fixées de parasites par élimination des résidus de la digestion.
Pour ce faire, on joue sur les densités et affinités différentes de ces résidus et des parasites recherchés.
La grande diversité des constituants des selles et des espèces parasites explique que les concentrations ne puissent être totalement efficaces sauf peut-être les concentrations dites combinées qui sont en réalité la succession de plusieurs techniques sur le même échantillon de selles.
Seront donc envisagées successivement les méthodes physiques, les méthodes physico-chimiques et les méthodes combinées.
Dans le grand nombre de méthodes proposées seront présentées celles qui, pour leur commodité et leur efficacité, sont les plus utilisées dans les laboratoires français dont les résultats semblent très fiables sur le plan international.
Techniques générales
Le choix des techniques
- Enquête épidémiologique spécifique
Pour une enquête recherchant une espèce particulière de parasite, on devra choisir une technique plus spécifique pour trouver ce parasite. Il faudra tenir compte de sa facilité d'exécution et de son prix de revient.
- Enquête épidémiologique générale sur le terrain
Pour une étude plus générale, les techniques devront être faisables après transport donc fixation des matières fécales. Le fixateur peut modifier le résultat de certaines techniques par ailleurs très efficaces.
-Analyse coproparasitologique pour un malade
Il est recommandé pour un cas clinique particulier d'effectuer soi! une technique combinée soit deux techniques différentes sans hésiter à pratiquer une voire deux autres techniques sî l'interrogatoire ou les renseignements cliniques permettent une orientation vers une parasitose donnée.
Prélèvements pour concentration
Aussi bien certains œufs que les kystes sont répartis irrégulièrement dans les matières éliminées en une seule défécation. Il est donc nécessaire de prélever des fragments de selles à différents endroits à l'aide d'un agitateur de verre aplati en palette.
Homogénéisation, flltration
- Homogénéisation
Quel que soit le liquide diluant, les selles devront être triturées dans un verre à pied, au début dans une très petite quantité de liquide pour obtenir une pâte qui sera secondairement étendue. Le résultat sera un diluât correspondant A ce qui est recommandé pour la technique choisie.
- Filtration
Pour éliminer les particules alimentaires non fragmentées (peaux de fruits par exemple), le diluât obtenu est filtré à travers une passoire (forme chinois) à mailles de 1 mm2 environ et de 7 cm d'ouverture et recueilli dans un autre verre à pied.
Un peu de liquide propre permet de rincer la passoire et d'emporter les éventuels œufs restés dans les mailles.
La passoire, après usage, sera brossée et flambée (destruction d'œufs éventuellement restés accrochés dans les mailles).
- Brève sédimentation
Après moins d'une minute le filtrat sera transvasé lentement dans un autre verre ou directement utilisé. Ces quelques secondes de sédimentation permettent aux petits éléments lourds de tomber dans le fond du verre à pied (cellules sctéreuses de poires par exemple).
Concentrations par les méthodes physiques de sédimentation
Sédimentation simple
- Intérêt
Technique recommandée pour les larves d'anguillule et les œufs d'ascaris non fécondés. Elle ne nécessite pas de produit chimique particulier.
- Inconvénients
De nombreuses cellules végétales (féculents en particulier) sédimentent aussi vite que les parasites recherchés et l'examen microscopique n'est pas toujours facile.
- Déroulement de la technique
Dix à vingt grammes de selles sont dilués dans 250 à 500 ml d'eau du robinet et le filtrat laissé dans un verre à pied. Après une heure, le surnageant est rejeté et le sédiment remis en suspension dans une même quantité d'eau. La même manipulation est renouvelée plusieurs fois jusqu'à obtention d'un liquide surnageant clair. Le culot est alors examiné.
Certains, au lieu d'attendre la sédimentation, gagnent du temps par des centrlfugations lentes.
Méthode de Faust et Ingalls en eau glycérinée
- Intérêt
Celte technique de terrain est employée pour rechercher les œufs de Schistosoma mansoni mais permet aussi de trouver œufs d'Ascaris non fécondés et larves d'anguillule.
- Inconvénients
Comme pour la technique précédente, l'examen microscopique peut être rendu difficile par la présence de certains résidus.
- Déroulement de la technique
Cinq grammes de selles sont dilués dans 300 ml d'eau glycérolée à 0,5%. On pratique trois sédimentations successives en verres à pied d'une durée de 1 heure, 45 minutes puis 30 minutes.
Les œufs de schistosomes sont plutôt en superficie du sédiment mais il est recommandé d'effectuer des prélèvements A différents niveaux.
Méthode de Van Someren et Grégoire en colonne haute
- Intérêt
Cette technique vétérinaire est utilisée par certains médecins pour rechercher essentiellement les œufs de grande douve.
- Inconvénients
L'inconvénient majeur de cette technique réside dans la nécessité d'utiliser un appareillage spécial c'est-à-dire un tube de verre de 1 cm de diamètre intérieur et de 2,10 m de haut. En bas de ce tube un tuyau de caoutchouc de quelques centimètres peut être fermé par une pince. Il relie le grand tube de verre à un autre tube de verre, court, muni d'un robinet.
- Déroulement de la technique
Le grand tube est empli de solution de Teepol à 1 % en évitant une forte agitation (bulles). Quatre grammes de selles diluées dans 3(j ml de celle même solution sont tamisées à travers la passoire ordinaire voire A travers une deuxième passoire à mailles plus fines (un tiers de millimètre de côté).
Le filtrat est versé lentement dans le liquide de la colonne. Après 20 minutes exactement la pince du tuyau en caoutchouc est serrée et. au robinet, on recueille quelques gouttes de liquide où se sont condensés les œufs de douve particulièrement denses (densité : 1,2).
concentration par les méthodes physiques de flottation
Les méthodes de flottation reposent sur le principe que les œufs ont une coque qui les protège pendant un certain temps de la pénétration de liquides plus denses; une dilution avec ces liquides aura tendance A les laisser flotter en surface tandis que les résidus plus lourds ou ceux qui s'imprègnent rapidement tombent dans le fond des récipients.
Comme pour les méthodes de sédimentation, la simplicité des formules pour préparer le liquide de dilution ne nécessite pas un alinéa spécifique pour le formulaire.
Méthode de Willis
- Intérêt
Dans les enquêtes épidémiologiques, cette technique présente l'avantage de la simplicité d'exécution, de la rapidité et d'un faible prix de revient (eau chlorurée sodique). Elle concentre bien les œufs d'ancylostomidés et dhyménolépidés.
- Inconvénients
La solution de chlorure de sodium pénètre assez facilement dans les œufs et il ne faut pas dépasser le temps prescrit dans le déroulement de la technique.
- Déroulement de la technique
Les selles sont diluées au dixième environ dans une solution aqueuse de chlorure de sodium à saturation (25 grammes dans 100 ml environ; densité 1 200), puis filtrées rapidement.
La suspension obtenue est versée dans un tube jusqu'à la limite supérieure (léger bombement du liquide au dessus du bord)* On place alors
délicatement une lamelle qui doit recouvrir tout le tube sans bulle d'air.
Un quart d'heure plus tard on retire la lamelle qui est déposée sur une lame et la lecture de la concentration est effectuée avant évaporation de Veau et cristallisation du sel ce qui. en pays chaud, peut se produire rapidement.
Méthode de Faust simplifiée
- Intérêt
Alors que la méthode originale exige plusieurs sédimentations dans Peau par centrifugalion, avant la flottation, dans la méthode simplifiée
on se contente d'une seule centrifugation.
- Inconvénients
La densité du liquide de dilution (1,18) est proche de celle de la solution de Willis et n'a pas l'avantage de la simplicité pour se procurer le corps chimique de base (sulfate de zinc). Cette méthode ne permet guère de trouver plus d'œufs que la méthode de Willis. Elle exige
l'utilisation dune centrifugeuse.
- Déroulement de la technique
Les selles sont diluées au dixième environ dans une solution saturée de sulfate de zinc (sulfate de zinc 331 g, eau qsp 1000 ml), tamisées et centrifugées environ une minute à 2300 tours/minute. Dès l'arrêt de la centrifugation, on prélève à l'anse métallique la couche superficielle qui contient les œufs et on la dépose sur une lame pour examen.
Méthode de Janeckso et Urbanyl
- Intérêt
La technique proposée par Janeckso et Urbanyi concentre bien les œufs de grande douve, de schistosomes et d'ancylostomidés ainsi que les larves d'anguillule dont les déformations éventuelles n'Interdisent pas la reconnaissance* Elle concentre assez bien tes embryophores de ténia et les unifs de trichocéphale.
- Inconvénients
La solution iodo-mercurique est toxique (étiquette rouge), doit être conservée dans un flacon bien bouché et est très corrosive. Elle forme avec les métaux des balances, des divers matériels (centrifugeuse, tuyaux de plomb) et surtout des bijoux (alliances, montres-bracelets), des amalgames irréversibles. Comme presque toutes les méthodes de flottation, cette technique est Inefficace pour trouver les kystes sauf ceux de Giardia.
-Déroulement de la technique
Trois à cinq grammes de selles sont triturés dans 20 ml de la solution iodo-mercurique (biiodure de mercure 150 g, iodure de potassium 110 g et eau 400 ml).
Pour préparer la solution : dissoudre l'iodure dans un peu d'eau, ajouter le biiodure en remuant, puis après dissolution complète, ajouter le reste de l'eau. La densité obtenue est de l 440.
Après tamisage, le filtrat est centrifugé à 2 500 tours/mn pendant 3 à 4 minutes. La couche superficielle recueillie à l'aide dune anse ou d'une baguette de verre aplatie en spatule est examinée au microscope dans le quart d'heure qui suit.
Méthodes physico-chimiques (méthodes diphasiques)
Principes théoriques
- Principes
Par une solution chimique, certains résidus fécaux sont dissous et d'autres acquièrent une affinité pour l'éther. Le principe de ces techniques est donc de mélanger les selles avec une solution déterminée puis d'agiter le tout avec de l'éther avant de centrifuger pour recueillir œufs
et kystes.
Bailenger a montré que le pH de la solution était l'élément déterminant pour la plus ou moins grande efficacité d'une technique selon le parasite recherché. Par exemple, pour les œufs d'ankylostomes, un pH acide est plus favorable mais en revanche, pour les omfs de S. mansoni, il recommande un pH basique.
- Détails techniques de la centrifugation
. Préparation
Les selles triturées (mélange au dixième environ) dans la solution choisie sont tamisées à travers une passoire comme cela est décrit pour les techniques physiques puis, après moins dune minute de brève sédimentation, le filtrat est versé dans un tube à centrifuger à fond conique
en le remplissant à moitié ou aux deux tiers.
On ajoute de l'éther en laissant un espace vide au dessus de la couche éthérée pour permettre une bonne agitation.
Le tube bouché à la main protégée d'un gant (matériau non soluble dans l'éther) est alors agité énergiquement pendant au moins trente secondes à une minute et, sauf pour le M.I.F.-concentration, aussitôt centrifugé. Il faudra prendre garde aux possibles petites projections d'éther souillé en retirant la main de l'orifice du tube.
.Centrifugation
La suspension éthéro-Hquide obtenue est centrifugée A une vitesse lente de l'ordre de 1500 à 2000 tours/minute pendant une à trois minutes.
- Résultats de la centrifugation
Après centrifugation, les constituants de la suspension sont répartis en quatre couches :
. couche superficielle d'éther coloré par les corps éthéro-solubles (graisses diverses) ;
. couche épaisse et adhérant aux parois du tube, contenant les résidus lipophiles ;
. couche de solution aqueuse de dilution colorée par les corps hydrosolubles ;
. culot devant contenir les parasites et qui doit être aussi petit que possible voire presque indiscernable à l'oeil nu.
- Suite de la technique
. Décoller la couche des résidus lipophiles à l'aide d'une baguette de verre.
. Retourner le tube au dessus de l'évier (en faisant couler de l'eau) ou d'un bac à déchets liquides.
Penser qu'ainsi est jeté de l'éther, donc travailler loin d'une flamme ou... d'une cigarette; penser également que, dans la technique au MlF-concentratlon (comme précédemment dans la flottation de Janeckso-Urbanyi), sont rejetês des sels de mercure considérés comme toxiques et faisant l'objet d'une réglementation pour le contrôle sanitaire des eaux usées. En France, les liquides contenant des sels de mercure doivent être recueillis dans des récipients de plastique bouchés, qui seront confiés à des services spécialisés. . Essuyer les parois du tube avec un coton tenu à la pince en laissant toujours le tube avec l'ouverture dirigée vers le bas pour éviter de souiller le culot avec les résidus.
. Retourner alors le tube et ajouter une goutte de solution isotonique pour remettre en suspension le culot qui sera examiné;
- Prélèvement du culot
Le culot sera prélevé à la pipette Pasteur mais il est impératif de ne pas aspirer. Le liquide devra monter par capillarité dans l'effilure, au besoin en penchant légèrement te tube. En aspirant on risquerait, en effet, que le culot ne montât au delà de l'effilure et que les parasites
recherchés et le liquide se répartissent sur toute la surface interne de la pipette Pasteur : tout serait alors à refaire.
Méthode de Telemann modifiée par Rivas
- Avantages
Facile à pratiquer, rapide, cette technique concentre bien les parasites les plus courants (Gfordia, Entomet œufs de trichocéphale).
La coque des kystes d'Entamœba histolytica se dédouble lors de la centrifugation ce qui est un argument diagnostique intéressant.
- Inconvénients
Les œufs de bilharzies, d'ascaris ou de grande douve restent dans la couche lipophile: c'est donc une méthode à déconseiller dans les pays où sévissent ces parasites.
- Déroulement de la technique
Aucune particularité n'est à signaler par rapport À la technique générale des concentrations diphasiques.
Méthode de Caries et Barthélémy
- Avantages
Par cette technique le culot obtenu est très faible et, débarrassés de la majorité des bactéries des selles, tes parasites apparaissent "propres". Les œufs de trichocéphale ou d'ankylostome et les kystes amibiens sont retrouvés aisément et facilement identifiables.
- Inconvénients
Le pH particulièrement bas (1,8 est défavorable pour retrouver les œufs de schistosomes ou les larves d'anguillule. Par ailleurs la technique exigeant deux centrifugâtions est plus longue que les techniques en un temps.
- Déroulement de la technique
Une première centrifugation du filtrat obtenu après dilution dans le liquide A (eau isotonique formolée) permet d'éliminer, avec le surnageant, des bactéries et des substances hydrosolubles.
Une seconde centrifugation est effectuée après mise en suspension du culot dans le liquide citrique B et agitation avec une quantité égale d'éther. Seul le culot est examiné.
Méthode de Bailenger
La méthode proposée par Bailenger tient compte de l'importance du pH mais la technique ne diffère pas de celle de Telemann et Rivas.
- Avantages
Elle est beaucoup plus fiable dans la recherche des kystes et des œufs se concentrant bien dans un pH aux environs de 5 (giardia. amibes, trichocéphale, ankylostome).
- Inconvénients
Pour rechercher les œufs de schistosome une autre technique est nécessaire.
- Déroulement de la technique
Les manipulations sont identiques à celles de la méthode de Telemann et Rivas.
Méthode de Thébault simplifiée (Valentin et Solle)
La méthode de Thébault est en réalité une méthode combinée mais rares sont les techniciens qui n'utilisent pas la méthode simplifiée proposée par Valentin et Solle.
- Avantages
L'émulsion avec l'éther est pratiquée dans une ampoule à décanter et par conséquent il est possible de techniquer sur une plus grande quantité de selles.
Cette méthode est particulièrement intéressante pour concentrer les kystes des petites amibes et en particulier les Eudolimax i\\atw$ dont les noyaux deviennent, grâce au formol du liquide de dilution, extraordinairement nets. On retrouve également, fixées, des formes égétatives d'amibes et les œufs de trichocéphale.
- Inconvénients
Les kystes d'Entamoeba coli et surtout de Giadia descendent assez mal. C'est donc une excellente méthode à utiliser seulement pour réciser
le diagnostic de rares kystes observés à l'examen direct ou après une méthode altérant leur morphologie.
- Déroulement de la technique
On dilue 10 g de selles environ dans 100 ml de solution d'acide trichloracétique. Le filtrat obtenu après tamisage doit reposer une minute avant d'être versé dans une ampoule à décanter (forme ballon ou forme poire). On ajoute une quantité égale d'éther et on agite rigoureusement en faisant évacuer l'éther vaporisé par ouverture du robinet tenu en haut (risques de projection du bouchon si ce geste n'est pas effectué).
On laisse reposer 2 à 10 minutes avant de retirer le bouchon et de soutirer quelques centimètres cubes que l'on centrifugera. Le culot sera examiné au microscope. Dans la technique originelle le culot est repris par la solution bromurée. Une deuxième centrifugation permet, par flottation, de recueillir les parasites en surface. La technique originelle de Thébault est donc une méthode combinée.
Méthode de Ritchie simplifiée
- Avantages
Cette méthode peut être utilisée sur les selles formulées donc sur des selles collectées pour enquêtes épidémiologiques. Elle concentre bien les œufs d'ascaris et de schistosome.
- Inconvénients
Le culot souvent volumineux est de lecture difficile.
- Déroulement de la technique
Mis à part le liquide de dilution, la technique est la même que pour la concentration de Teleman-Rivas.
Méthode de Blagg et al.
- Avantages
Celte méthode permet de concentrer les œufs de schistosome et d'ascaris. Les kystes de protozoaires voire les formes végétatives sont colorés et ainsi facilement identifiables.
- Inconvénients
Le culot obtenu est souvent important. La manipulation de grandes quantités de liquide coloré à l'éosine augmente les risques de taches et surtout la présence de mercure souille les effluents du laboratoire.
- Déroulement de la technique
Les selles sont diluées au dixième dans la solution de merthiolate-formol, pure ou additionnée de Lugol à 5 % (cf. coloration des selles). Après tamisage le filtrat est versé dans un tube à centrifuger où l'on ajoute moitié moins d'éther. Une agitation énergique permet d'obtenir une suspension qu'on laisse reposer deux minutes.
Si la suspension reste stable la centrifugation (1700 tours/minute pendant 1 minute) permet d'obtenir un culot qui sera prélevé avec les soins habituels et examiné.
Si l'éther forme une couche superficielle libre il faut ajouter un millilitre d'eau et recommencer l'agitation.
On remet de l'eau jusqu'à l'obtention d'une suspension stable après deux minutes et c'est alors seulement que la centrifugation peut être effectuée.
Méthodes combinées
Chaque méthode de concentration proposée présente l'inconvénient d'éliminer des parasites et doit donc être choisie en (onction de ce que Ton recherche préférentiellement.
Les méthodes les plus intéressantes pour la diversité des kystes ou œufs concentrés laissent souvent à examiner un culot relativement important,
En combinant ftottations et méthodes diphasiques, C. Junod obtient d'excellents résultats.
Première méthode de Junod
- Avantages
Les statistiques publiées par Fauteur de cette méthode montrent sa productivité. C'est certainement Tune des méthodes les plus intéressantes tant pour les recherches d'ceufs que pour celles de formes végétatives ou kystes de protozoaires. Elle remplace l'exigence
de plusieurs techniques différentes pour trouver des parasites de densité différente.
- Inconvénients
Cette technique nécessitant cinq centrifugations demande un temps assez long. D'autre part l'utilisation d'une solution d'iodo-mercurate présente les inconvénients déjà signalés pour la méthode de (aneckso et Urbanyi (solution toxique et corrosive).
- Déroulement de la technique
. Concentration diphasique (M1F Concentration ou Bailenger) en utilisant peu d'élher et en agitant modérément pour obtenir volontairement un culot important (première centrifugation).
. Le culot est remis en suspension dans une solution de sulfate de zinc à saturation. On pratique alors une deuxième centrifugation pendant 30 secondes S faible vitesse ce qui permet d'obtenir un surnageant et un culot (deuxième centrifugation)
. Ce surnageant est dilué au quart avec de l'eau distillée et centrifugé (troisième centrifugation); le culot est examiné.
. Le culot de la deuxième centrifugation est repris dans une solution d'iodomercurate de potassium de densité 1,5 (cf. formulaire) et la suspension est de nouveau centrifugée (quatrième centrifugation). Le surnageant est repris et dilué. Ce dernier diluât est centrifugé (cinquième centrifugation) et le culot est examiné.
Deuxième méthode de Junod (Junod simplifiée)
- Avantages
C. Junod considère que sa technique simplifiée donne autant de bons résultats que la technique complète.
- Inconvénients
Quoique simplifiée, la technique impose encore quatre centrifugations et l'emploi d'une solution de iodomercurate.
- Déroulement de la technique
. Mettre en suspension environ 8 g de selles dans 50 ml de solution de NaCI à 8,5 %o, éventuellement formolée à 8 %. Tamiser, centrifuger à
1200 tours/minute pendant une minute, éliminer le surnageant, faire une préparation d'une microgoutte du culot, l'examiner et remettre en suspension le reste du culot dans 20 ml d'une solution isotonique formolée.
Remarque : quand cette méthode combinée intervient en complément d'une technique polyvalente usuelle, cette première centrifugation peut être supprimée.
. Ajouter 5 à 7 ml d'éther éthylique, agiter modérément, centrifuger à 1200 tours/minute pendant une minute et conserver le culot.
. Remettre le culot en suspension dans 4 à 6 ml de solution d'iodomercurate (solution B ci-dessous de densité 1,40), centrifuger à 1200 tours/minute pendant deux minutes: évacuer le surnageant et examiner le culot en totalité au microscope.
Méthode de sédimentation-flottation pour œufs et larves
- Avantages
Pour une recherche spécifique d'œufs ou de larves, Junod considère que la méthode ci-dessous est plus productive.
- Inconvénients
Quand la teneur des selles en lipides est anormalement élevée, les concentrations sans éther sont encombrées de graisses neutres, savons et acides gras.
- Déroulement de la technique
. Première centrifugation (1200 tours/minute, une minute) de la suspension fécale en eau 5 8,5 % de NaCl; culot conservé.
. Mise en suspension du culot dans 20 ml de solution acéto-acétique formulée sans adjonction d'éther et centrifugation à 1200 tours/minute
pendant une minute; aspirer le surnageant et la partie superficielle du culot.
. Mise en suspension du culot dans 5 à 7 ml de solution d'iodomercurate de potassium de densité 1,35 et centrifugation (1200 tours/minute pendant une minute).
. Transfert (décantation) du surnageant dans un autre tube conique, adjonction de 20 ml d'eau et centrifugation (1200 tours/minute pendant deux minutes).
. Examen du culot
Sédimentation-flottation au saccharose pour protozoaires
- Avantages
Également mise au point par C Junod, cette technique, bien exécutée, permet de trouver de rares formes végétatives de protozoaires alors que les kystes sont inexistants. Elle est d'exécution rapide et surtout recommandée quand l'examen direct a prouvé la présence de rares formes végétatives et qu'aucun kyste n'a été retrouvé pour pouvoir affirmer le diagnostic. Elle est utilisable sur des selles fixées au MLR
- Inconvénients
Une certaine technicité est indispensable pour ne pas confondre les amibes et flagellés avec les blastocystis et champignons qui sont un peu déformés. De plus une selle trop riche en lipides ne peut être ainsi concentrée. Noter en outre que des sels de mercure sont encore utilisés.
- Déroulement de la technique
. Fixation :
■ triturer 3 à 4 grammes de selles dans 50 ml de solution acéto-acétique formolée fraîchement préparée (solution MIF) ;
■ tamiser et recueillir en tube bouché ;
■ attendre au moins 2 à 3 heures avant de poursuivre.
. Sédimentation
■ centrifuger 10 à 15 ml de la suspension à 1800-2000 tours/minute pendant 90 secondes dans un premier tube (T1) ;
■ rejeter le surnageant ;
■ prélever (lame 1) el garder en milieu humide (boîte avec colon hydraté) la couche supérieure du culot.
. Flottalion
■ verser, dans le tube Ti, 8 & 10 ml de solution de saccharose (cf. formulaire) puis 0,5 ml de solution de chlorure mercurique à 1,5 % en eau distillée;
■ agiter très doucement (éventuellement avec un agitateur) ;
■centrifugera 1000 tours/minute pendant 45 secondes;
■décanter le surnageant dans un tube T2 (si une partie est peu limpide ne garder que 1 ou 2 ml de la partie supérieure) ;
■ prélever et garder ta surface du culot (lame 2).
. Précipitation
■ ajouter 20 à 30 ml d'eau dans le tube T2 et diluer le culot ; • centrifuger à 2000 tours/minute pendant 90 secondes ;
■ examiner le culot (lame 3).
. Lecture dans l'ordre des lames 3 puis 1 et 2 si la lame 3 n'est pas satisfaisante.

Admin- ADMINISTRATEUR

- Messages : 280
Date d'inscription : 05/02/2010
Localisation : Sur la terre
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
salvation a écrit:sihem-22 a écrit:Svp si qq1 peu repondre aux questions:
1) 4 helminthe provoquant une anemie?
2) 2 helminthe ou l'autoinfestation est possible?
3) Parasite qui penetre chez homme a l'etat larvaire et adulte et parasitose produit par ces 2 etats.
4) 3 affections mycosiques consécutives a un traumatisme.
5) 4 champignons dimorphiques ?
6) 4 nematodes tansmission par des larves?
7) 3 especes : filamenteuse levuriforme et dimorphique.

1. Trichuris trichura ,Ankylostomoses( Ancylostoma duodenale , Necator americanus ),
Bothriocéphale (anémie de type macrocytaire et mégaloblastique -pseudobiermérienne- due à la fixation par le parasite de la vitamine B12 )
2. Oxyurose(Eterobius vermiculeris) ;Anguillule ,Taenia solium
3.si vous parlez du parasitisme
a l'etat larvaire :Ecchinococcus granulosis (hydatidose);Echinococcus multilocularis (echinococcose alveolaire);
a l'etat adulte taeniasis :Taenia saginata /solium ,Hymenolepis nana;Diphyllobothrium latum.....
Taenia solium peut parasité l'homme aussi a l'etat larvaire (Cysticercose)
4. Sporotrichose (Sporothrix schenckii) ; Chromomycose ; mycetome fongique;lobomycose (Loboa loboi)....
5.Champignons dimorphiques :Histoplasma capsulatum/duboisii,Coccidioidomycose(Coccidioides immitis) ;Parcoccidioidomycose (Paracoccidioides braziliensis) ;Blastomycose (Blastomyces dermatitidis );Sporotrichose(Sporothrix schenckii )[FLORA
];Pénicilliose(Pénicillium marneffei)
6.levuriforme: Candida sp(C. albicans), Malassezia sp (M. furfur),Cryptococcus sp.(C. neoformans)
filamenteux : dermatophytes (Microsporum canis , Trichophyton mentagrophytes,Epidermophyton floccosum )
moisissures ([i]Aspergillus sp. ...


J'espère que j'ai pu repondre à ta question
Voila ta réponse Sihem

Flora- Résident II

- Messages : 235
Date d'inscription : 13/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
Flora a écrit:
Examen direct à l'etat frais en parasito et en myco :
Interet
Application
Limites
salvation a écrit:pour l'examen direct en mycologie ,
il est indispensable au diagnostic , en cas de positivité , il oriente le clinicien .
dans des dermatophytes ex: teignes du cuir chevelu il apport le diagnostic immédiat qui permet la mise en route d'une thérapeutique sans attendre les résultats de la culture .
* il peut être un examen d'urgence ; le pronostic vital est mise en jeux par une cryptococcose cérébral dont l'examen mycologique a l'encre de chine du LCR peut mettre en évidence l'agent pathogène; levure encapsulé .
* dans le cas des champignons dimorphiques ou la culture est considéré comme très dangereuse l'ED reste l'outil Dc adéquat .
1.Examen direct à l'état frais sans préparation; flore vaginal ou grains de mycetome.
2.Examen direct après éclaircissement pour les chevaux , squames ou ongles
l'éclaircissant contient du potasse ou lactophenol ;additionné ou non d'un colorant .
3.Examen direct après coloration (frottis), des liquides,sérosités et appositions de tissus .
mais reste que la culture est toujours nécessaire pour l'identification des espèces .
Admin a écrit:
Déroulement des examens directs en techniques courantes
Examen microscopique standard
Examen direct en solution salée Isotonique
L'examen direct est le temps majeur de l'examen coproparasitologique. On dit parfois que dix examens directs bien effectués sont souvent plus intéressants et plus fiables que deux concentrations hâtivement lues.
A l'aide d'une fine baguette on prélèvera des selles en superficie et en profondeur À différents endroits en privilégiant les zones où des anomalies sont patentes (mucus sanglant).
Ces petites particules de matière fécale seront diluées sur lame dans une goutte de soluté NaCl à 9 °/oo, éventuellement tiédi.
La dilution doit être suffisante pour que, après écrasement sous une lamelle, il soit possible de reconnaître les caractères d'un journal à travers la préparation.
L'écrasement se fera avec le doigt protégé par un papier buvard et des doigtiers ou des gants protecteurs (absorption de l'excès de liquide et hygiène individuelle).
On lira toute la ou les préparations aux objectifs faibles et on regardera au moins une centaine de champs microscopiques à l'objectif x 40. L'objectif à immersion sera réservé pour des études fines d'un parasite déjà repéré.
En solution de Lugol double
Les même dilutions seront effectuées dans une goutte de solution de Lugol double et examinées avec le même soin en sachant que, dans cette solution, les protozoaires s'immobilisent rapidement mais que la chromatine des noyaux colorée en sombre est bien nette.
Avec la solution de Lugol, la flore iodophile du colon apparaît en brun et l'amidon mal digéré en bleu ; l'amidon transformé en érythrodextrine est coloré en rouge violet.
La dilution en eau distillée
Elle peut être d'un certain secours lorsqu'une grande abondance de blastocystts ou de formes végétatives d'autres protozoaires rend difficile le repérage des kystes éventuels.
Ces derniers résistent bien à l'eau alors que les formes végétatives éclatent rapidement ; parfois avant de mourir elles se gonflent et leur noyau apparaît (Dientamœba fragilis).
Merci a vous deux
Je rajoute pour l'état frais:
Principe (Interet
 ): Permet de voir les trophozoites de protozoaires vivants donc la mobilité éventuellement. Coloration au lugol pour mieux observer le contour des kystes et noyaux.
): Permet de voir les trophozoites de protozoaires vivants donc la mobilité éventuellement. Coloration au lugol pour mieux observer le contour des kystes et noyaux.Matériel: Anse de platine ou pipette pasteur.
Lame et lamelle + MO.
Lugol = Iode + KI.
Mode opératoire: déposer dans un verre a pied une noix de selles prélevés a différents endroits avec un agitateur. Ajouter peu a peu le serum physiologique en ecrasant la selle. Mettre une goutte sur la lame et ecraser par la lamelle = ETAT FRAIS.
Avantages : Kystes et oeufs visibles grace au lugol + forme vegetatif pour l'état frais + mobilité.
Inconvenients: Chance réduites de trouver des parasites ou champignons.
Voila et bon courage.

Flora- Résident II

- Messages : 235
Date d'inscription : 13/03/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
merci beaucoup  vive entre aide entre pharmaciens
vive entre aide entre pharmaciens 
 vive entre aide entre pharmaciens
vive entre aide entre pharmaciens 

sihem-22- Etudiant
- Messages : 4
Date d'inscription : 03/04/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
svp une autre question interet de la methode quantitative ds le dg parasitologiq des helminthes.
merci d'avance
merci d'avance


sihem-22- Etudiant
- Messages : 4
Date d'inscription : 03/04/2010
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
Les méthodes quantitatives
La numération des oeufs d’helminthes est de plus en plus employée en parasitologie car elle permet :
■ d’évaluer l’intensité du parasitisme individuel : il est, en effet, possible de déduire, approximativement, le nombre de parasites adultes présents dans l’organisme à partir du nombre d’oeufs par gramme de selle (ou par vingt-quatre heures si on connaît le poids total des selles durant ce laps de temps). On estime ainsi que 100 oeufs d’Ascaris lumbricoïdes correspondent à 2 vers et que 50 oeufs de Necator americanus correspondent à 2 vers. Pour ce dernier parasite, la numération est très utile au diagnostic d’une anémie puisqu’on admet qu’il faut plus de 3 000 oeufs/g de selles pour que l’anémie soit d’origine parasitaire (pour Ancylostoma duodenale, il faut seulement plus de 1 000 oeufs /g de selles). Pour Schistosoma mansoni, on estime qu’environ 25% à 30% des oeufs pondus par une femelle sont retrouvés dans les selles, ce qui correspond à 80 oeufs /g de selle pour deux adultes ;
ce chiffre est en fait variable suivant l’ancienneté et l’intensité de l’infestation.
■ D’apprécier l’importance et la fréquence de la transmission.
■ De juger de l’efficacité d’un anthelminthique par des numérations pratiquées avant et après traitement.
La numération des oeufs utilise deux méthodes :
■ Pesée d’une certaine quantité de selle puis dilution soigneuse et examen d’une ou de plusieurs gouttes calibrées.
■ Examen d’un volume constant de selle après avoir, par des pesées préalables, déterminé le poids moyen correspondant au volume utilisé (en tenant compte de la consistance des selles).
La numération des oeufs d’helminthes est de plus en plus employée en parasitologie car elle permet :
■ d’évaluer l’intensité du parasitisme individuel : il est, en effet, possible de déduire, approximativement, le nombre de parasites adultes présents dans l’organisme à partir du nombre d’oeufs par gramme de selle (ou par vingt-quatre heures si on connaît le poids total des selles durant ce laps de temps). On estime ainsi que 100 oeufs d’Ascaris lumbricoïdes correspondent à 2 vers et que 50 oeufs de Necator americanus correspondent à 2 vers. Pour ce dernier parasite, la numération est très utile au diagnostic d’une anémie puisqu’on admet qu’il faut plus de 3 000 oeufs/g de selles pour que l’anémie soit d’origine parasitaire (pour Ancylostoma duodenale, il faut seulement plus de 1 000 oeufs /g de selles). Pour Schistosoma mansoni, on estime qu’environ 25% à 30% des oeufs pondus par une femelle sont retrouvés dans les selles, ce qui correspond à 80 oeufs /g de selle pour deux adultes ;
ce chiffre est en fait variable suivant l’ancienneté et l’intensité de l’infestation.
■ D’apprécier l’importance et la fréquence de la transmission.
■ De juger de l’efficacité d’un anthelminthique par des numérations pratiquées avant et après traitement.
La numération des oeufs utilise deux méthodes :
■ Pesée d’une certaine quantité de selle puis dilution soigneuse et examen d’une ou de plusieurs gouttes calibrées.
■ Examen d’un volume constant de selle après avoir, par des pesées préalables, déterminé le poids moyen correspondant au volume utilisé (en tenant compte de la consistance des selles).

Admin- ADMINISTRATEUR

- Messages : 280
Date d'inscription : 05/02/2010
Localisation : Sur la terre
 Re: Sujets d'examens (Parasitologie)
Re: Sujets d'examens (Parasitologie)
merci infiniment 


sihem-22- Etudiant
- Messages : 4
Date d'inscription : 03/04/2010
 Sujet pour la revision
Sujet pour la revision
1ère question sur 8pts :
donner la position systématique, le cycle et la réparttion géographique de la bilharziose qui existe en algerie , ainsi que le traitement aqéquat .
2ème question sur 6pts:
donner 8vecteurs ainsi que la forme du parasite transmise chez l'hôte et la maladie causée.
3ème question sur 3pts :
CAT devant un LCR
4ème question sur 3pts :
prophylaxie du kyste hydatique.
donner la position systématique, le cycle et la réparttion géographique de la bilharziose qui existe en algerie , ainsi que le traitement aqéquat .
2ème question sur 6pts:
donner 8vecteurs ainsi que la forme du parasite transmise chez l'hôte et la maladie causée.
3ème question sur 3pts :
CAT devant un LCR
4ème question sur 3pts :
prophylaxie du kyste hydatique.

pharminfo- Résident I
- Messages : 137
Date d'inscription : 11/03/2010
Localisation : Chez moi
 besoin d'aide
besoin d'aide
salut tout le monde
on a un examen de tp parasitologie pour le 16mai et je n'arrive pas a me préparer
si vous pouvez me donner certain conseil pour la recherche des oeufs et des kystes
meme si vous pouver nous postee la planche des oeufs et des kystes avec leurs dimensions
merci d'avance
on a un examen de tp parasitologie pour le 16mai et je n'arrive pas a me préparer
si vous pouvez me donner certain conseil pour la recherche des oeufs et des kystes
meme si vous pouver nous postee la planche des oeufs et des kystes avec leurs dimensions
merci d'avance

samsoma- Résident I
- Messages : 59
Date d'inscription : 04/05/2010
Page 1 sur 4 • 1, 2, 3, 4 
 Sujets similaires
Sujets similaires» sujets d'actuallité pour les formula one!! (les residents 1er année )
» Les revues en Parasitologie
» CAS CLINIQUE EN PARASITOLOGIE
» CAS CLINIQUE EN PARASITOLOGIE 02
» CAS CLINIQUE EN PARASITOLOGIE 03
» Les revues en Parasitologie
» CAS CLINIQUE EN PARASITOLOGIE
» CAS CLINIQUE EN PARASITOLOGIE 02
» CAS CLINIQUE EN PARASITOLOGIE 03
Page 1 sur 4
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|
